食品添加剂可以分为天然添加剂和人工合成添加剂2种,是食品工业根据人为选择添加的一种辅助试剂,可以对食物起到着色、保鲜、调味等作用[1]。但是由于人工合成的添加剂,在食品中的残留会对人体造成严重的危害,有些危害甚至是不可逆的,已经威胁到了人们的身体健康[2]。因此对于食品中添加剂的使用具有很严格的标准,对于食品中添加剂的残留剂量也有严格要求。尤其是各种着色剂、抗氧化剂、甜蜜素等化学合成品,其安全性问题一直收到社会各界的广泛关注[3]。
作为化学合成品,人工食品添加剂可以与人体中的生物成分结合,如与人体中的蛋白质发生反应,或者与DNA结合,改变人体生理结构,威胁身体健康[4]。为了对食品中残留的添加剂加以检测,分析添加剂的作用机理,可以研究添加剂与人体DNA的作用,并通过光学、电化学、分子学等方法进行定性、定量的研究[5]。目前最常见的光学研究方法主要包括紫外-可见吸收光谱、红外吸收光谱、荧光光谱、其他光谱等[6]。由于具有方便、快捷、成本低等特点,光学方法成为检测食品中食物残留添加剂的最有效也是应用最广的方法之一[7]。
本研究基于紫外-可见吸收光谱作为食品添加剂残留的检测手段,以叔丁基对苯二酚(TBHQ)、丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)等作为研究对象,分析其在食品残留中的表现和作用机制,关注小分子对于大分子的影响,为食品添加剂的使用指出了方向。并研究了TBHQ等对于DNA的作用机理,从理论上说明需要对食品添加剂加以控制。
1 实验原理
1.1 紫外-可见吸收光谱技术
光谱技术是目前研究材料组分、结构构成等的一种有效测量方法,可以用来研究样品中的化学组成,以及分析其含量多少。当光照射物质时,由于发生杂质能级跃迁,从而造成各种波长光子的吸收、散射和发射等变化,也会出现光谱能量强弱方面的变化,这些都可以用来反映物质的组分变化[8]。
光谱分析是现代化学分析检测中应用最广泛的技术之一,其功能强大、检测全面,同时检测灵敏度非常高、操作灵活、分析效果好,选择性明显,在生物、化学领域、食品检测以及医药成分分析等领域都有重要的作用[9]。
紫外-可见吸收光谱是指工作在紫外波段的一系列光谱,其波长范围一般选择200~800 nm,选择该波长范围内的光吸收程度或者发光效果,来分析物质组分的方法称为紫外-可见吸收光谱技术[10]。由于不同的组分分子对应的能级并不相同,当其出现价电子或者电子跃迁时,就会伴随相应的能量变化,从而可以根据光子的变化检测出物质的成分情况。
1.2 兰伯-比尔定律
兰伯-比尔定律是光谱检测的基本原理,适用于所用的物质光学吸收和电磁辐射变化,可以涵盖固体、液体、气体等所有物质,也可以适用于分子、原子、离子等微观组分[11]。其意义为当光照射到某一待测物质时,其对光线的吸收程度与物质组分的浓度和吸收层高度成正比例。从而可以有效解释光谱分析检测和分析材料组分的原理。
2 结果与分析
2.1 猪油中添加剂的检测
2.1.1 实验仪器
实验使用到的仪器和设备信息如表1所示。
2.1.2 实验材料
实验使用到的材料和试剂信息如表2所示。
2.1.3 实验处理
(1)猪油样品前处理
表1 实验设备与仪器
根据文献的记录,采用甲醇作为猪油的萃取剂,对其进行萃取,对不同的样品进行紫外光谱数据采集,比较其特征效果。猪油在甲醇中具有一定的溶解度,将其静置处理后,会从溶液中析出,因此处理后的样品不能直接进行色谱分析,否则会使色谱柱失效,甚至堵塞[12]。因此在猪油样品的前处理中,需要对其萃取液进行多次降温冷冻,从而使得猪油成分析出,再进行样品紫外光谱分析[13]。
选择表2中网购的猪油样品,利用电子天平称取2.0 g,称量精度0.001 g,将其置于10 mL离心管中,通过恒温水浴,水浴温度设定为65℃,将其完全融化。再向其中分批次滴入甲醇,每次滴入3 mL,滴3次,4500 r/min离心4 min。取上层甲醇溶液置入冰箱中降温冷冻,4500 r/min离心4 min,将上清液用甲醇定容处理,晃匀后可以得到待检测的猪油样品,用于紫外光谱检测。
表2 实验材料与试剂
(2)标准光谱
为了检测猪油样品中的食品添加剂,需要预先建立食品添加剂的标准光谱数据集,录入到数据库中[14]。本研究选择的食品添加剂分别为TBHQ、BHA、BHT,称取30 mg药品,将其溶解在甲醇中,而配制后的溶液为30 mL,溶液浓度1 mg/mL,将其置入棕瓶中,作为实验样品的标准液低温保存。
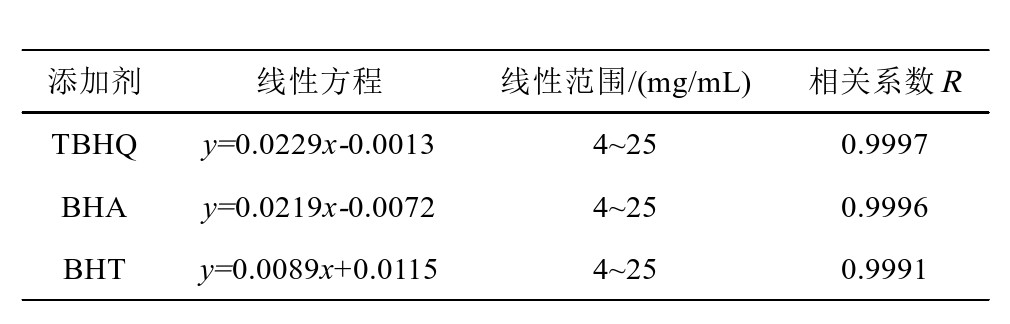
利用标准液配置成不同浓度的对应标准溶液,在不同紫外波长情况下,波长范围选择在200~400 nm,记录其光谱情况,从而形成数据库[15]。利用最小二乘法得到其回归方程[16],同时可以得到其相关系数和线性度情况,最大吸收波长处的线性方程如表3所示。
表3 食品添加剂的线性方程
(3)建立猪油紫外检测数据库
为了分析猪油中不同添加剂的紫外吸收光谱状态,将猪油样品与3种添加剂完全分离,从而形成不同状态下的紫外-可见吸收光谱数据,并进行相应的数据收集[17]。
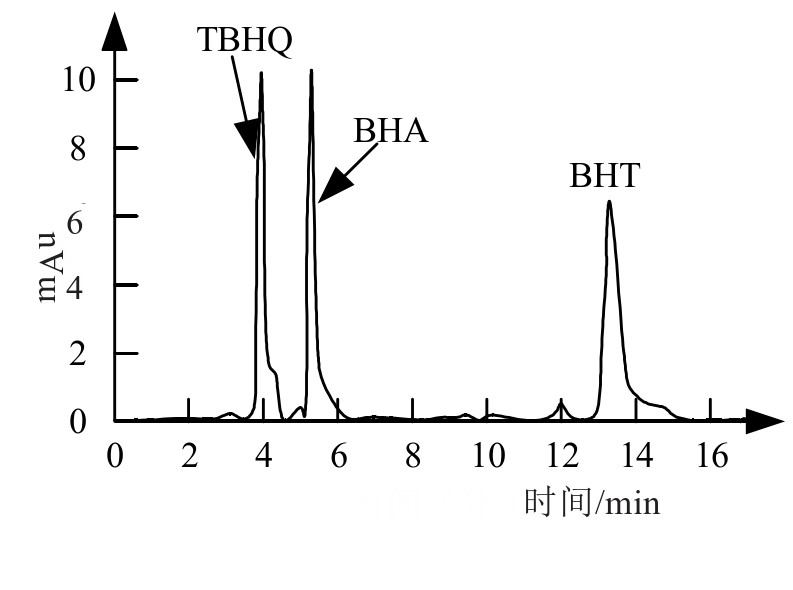
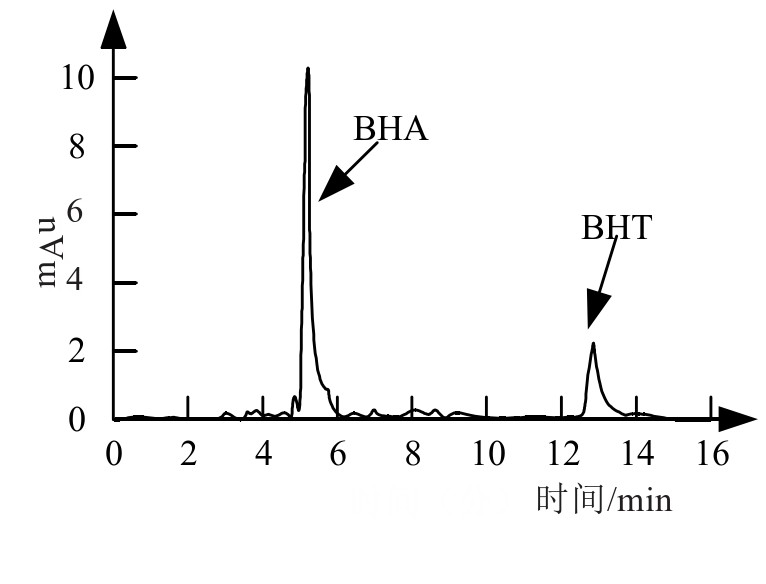
由于不同的抗氧化食品添加剂,出峰的时间并不相同,可以通过检测样品组分的形式得到其准确分离的时间[18]。3种抗氧化剂的混合溶液色谱图如图1所示,记录了3种组分的出峰情况。从中可以看到,经过4 min,TBHQ分离,出现吸收峰,而5 min左右BHA分离,对应吸收峰出现,最后出现的为BHT对应的吸收峰,时间约为12 min。由此可知静置14 min左右3种添加剂将完全分离。
图1 3种添加剂的液相色谱
对8种不同的猪油样品进行检测并编号,结果发现5号样品的色谱中含有BHA和BHT 2种添加剂成分。其色谱图如图2所示。
为了提高检测实验的适用性,并降低实验检测成本,本研究将紫外可见吸收光谱与液相色谱相连,将两者有机结合,用于获取猪油样品中的组分数据,将液相色谱数据转换成吸光度数据,用于组分辨识[19]。
为了快速测得猪油样品中的抗氧化剂组分,需要在本底的数据库中拥有足够的数据。即在检测所需测得的添加剂TBHQ时,对于其他组分的数据是已测的,从而可以在得到的测试数据中,减掉BHA、BHT 2种添加剂的测试峰,从而快速分析出其组分含量,计算结果也足够精确[20]。
图2 5号样品的色谱图
(4)联立数据库的降维
由于采用的色谱方法包括了紫外光谱和液相色谱,使得整个数据库获得的数据量过大,不利于数字计算和数据整理,并且测试过程中会伴随有系统噪声以及电压不稳、波幅抖动等非线性因素,使得数据处理过程必须要进行降维[21]。利用二阶差分法对获得的数据进行处理,通过折点判断系统的成分,提高运算效率[22]。
2.1.4 猪油样品检测结果
通过网购等方法[23],获得不同品牌的猪油,随机选择其中的8种作为实验样品,利用前文的方法进行溶液萃取和数据库建立,低温避光处理后,用于紫外可见吸收光谱检测,为了保证样品检测的准确性,每个实验样品均重复20次实验,获得多次数据并整理,得到其平均数据作为测试结果。
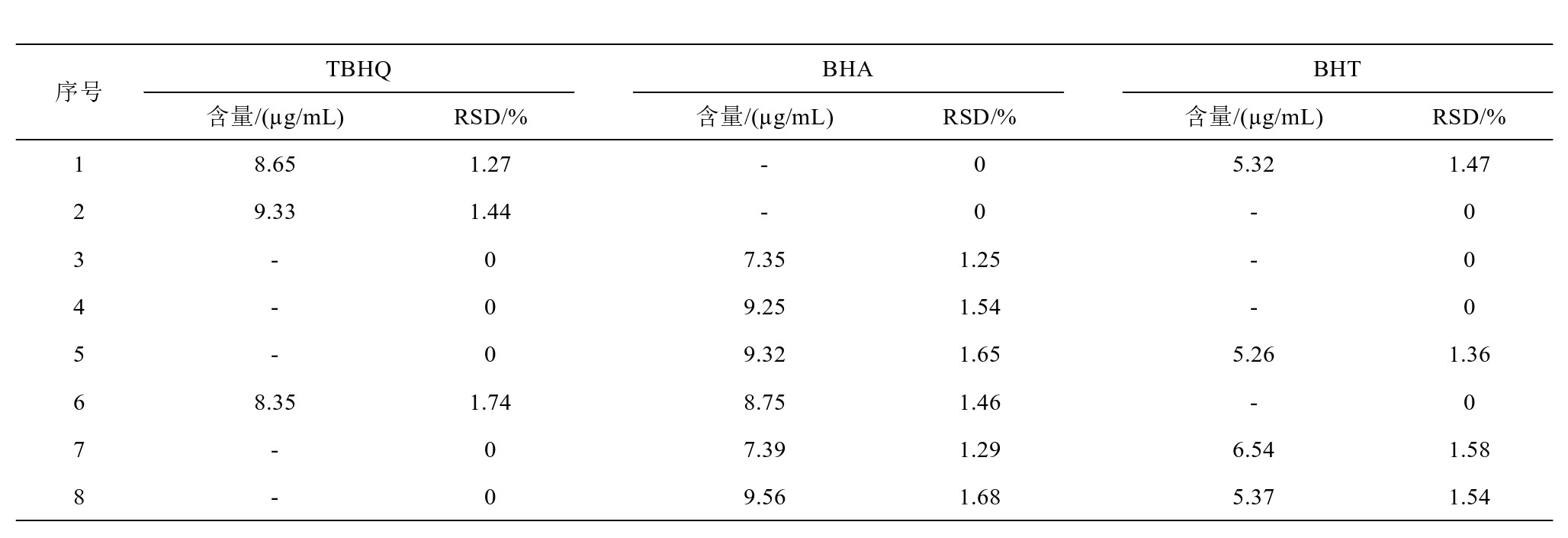
依据前文介绍的算法,对8种实验样品的组分进行分析,测得其3种抗氧化剂的含量如表4所示。对于待检测的抗氧化剂,其在不同猪油中的含量并不相同,1、2、6号的猪油的检测结果中含有TBHQ,但是1、2号猪油中不含有BHA,而2、3、4、6号猪油中不含有BHT,但由于上述添加剂的国家标准为小于0.2 g/kg,因此上述猪油中的添加剂成分均符合国家标准,猪油属于为合格产品。
2.1.5 检测结果的精密度和可靠性分析
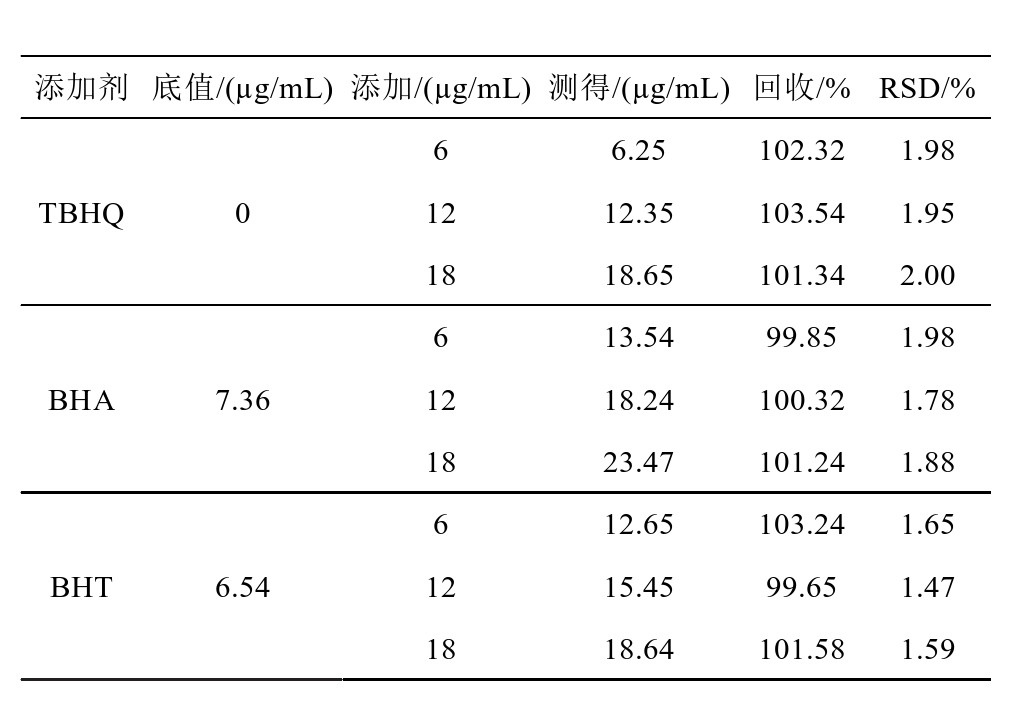
在现有实验样品的基础上,通过添加不同水平的添加剂方式,比较其样品回收率,并对于浓度不同的样品进行综合比较,比较检测结果的紧密程度[24]。结果如表5所示。可以看到,对于不同的样品添加剂浓度,其回收率都很高,均接近100%,RSD值的结果都低于2%,从而可以证明本研究实验方法具有较好的回收率,并且具有较高的检测精密度。
表4 样品中的抗氧化剂含量
表5 7号样品回收率测试
选择3号样品,相同条件下,进行不同时间上的多次实验,计算其稳定性。经过多次测试之后,TBHQ的含量均在11.45~12.53 mg/mL之间,RSD也稳定在1.68%~2.05%之间,另外2种抗氧化剂的含量也同样变化不明显,证明该方法的稳定性,可适用于样品检测。
2.2 抗氧化剂TBHQ的作用机理研究
2.2.1 实验仪器
实验使用到的仪器和设备信息如2.1.1节中表1所示。
2.2.2 实验材料
实验使用到的材料和试剂信息如表6所示。
表6 实验材料与试剂
2.2.3 实验安排
抗氧化剂TBHQ等会在体外实验中破坏DNA的结构,两者相互作用会使DNA氧化损伤,产生危害[25]。利用光谱检测的方法,以小牛胸腺DNA(ctDNA)为研究对象,研究了TBHQ等与ctDNA作用,并将作用后的产物通过紫外光谱检测。实验采用MCR-ALS处理方法,选择不同的滴定方法,测其光谱结果。
实验1:不改变抗氧化剂TBHQ的浓度(0.012mg/mL),向其中匀速添加ctDNA (0.4 mg/mL),使得混合溶液中的ctDNA的含量持续增大,直至ctDNA的浓度达到0.019 mg/mL。
实验2:不改变小牛胸腺DNA的浓度(0.015 mg/mL),每次增量为0.0088 mg/mL的TBHQ溶液滴加到ctDNA溶液中。
滴加后的溶液需要静置一段时间,待其混合均匀后再进行紫外扫描。将扫描后获得的两组矩阵进行合并,构建一个新的矩阵,利用MCR-ALS方法进行理论分析。
2.2.4 实验结果
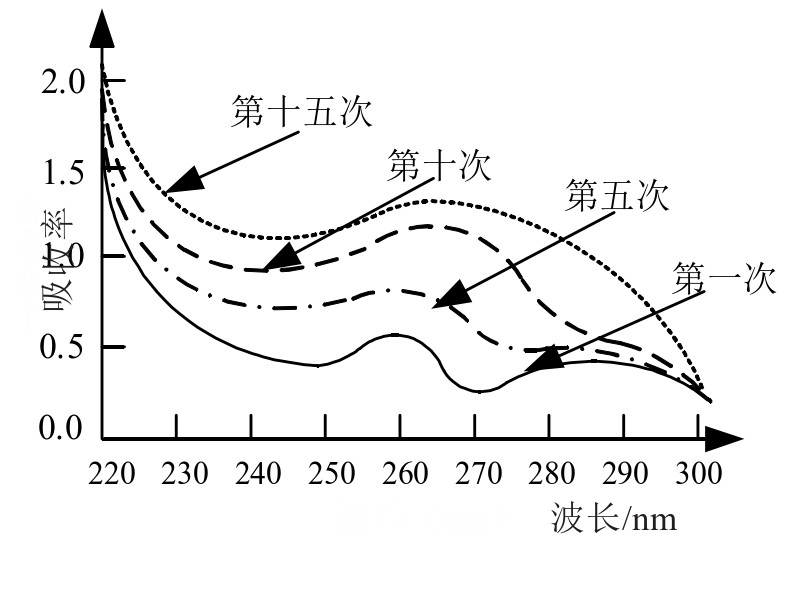
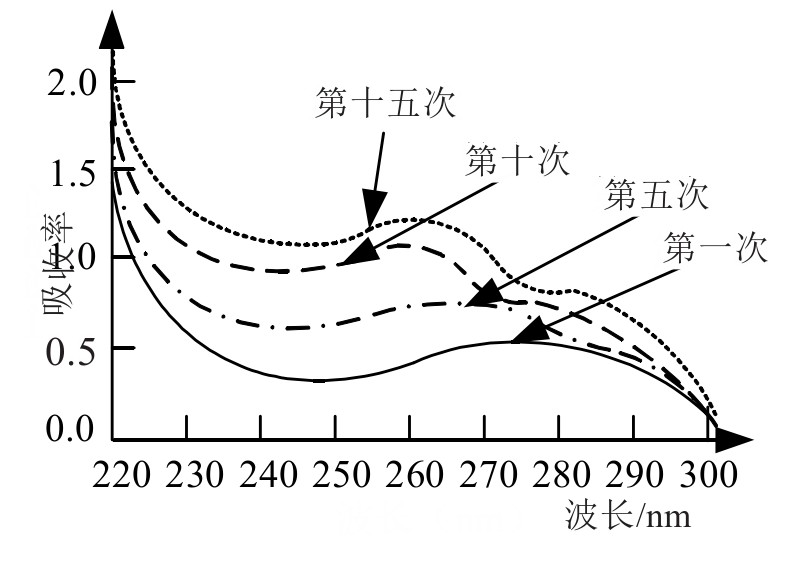
紫外可见吸收光谱扫描后获得的曲线图如图3、4所示。从图3中可以看到,TBHQ的紫外吸收光谱,在该情况下存在2个明显的吸收峰,波长分别位于260 nm和287 nm,随着ctDNA的含量逐渐提高,吸收峰出现了明显增强,尤其是260 nm处的吸收峰,甚至出现了红移情况,证明两者之间确实发生了某种变化,并相互作用。
图4中说明,对于实验2中的情况,ctDNA的紫外吸收光谱存在一个吸收峰,波长位于258 nm。并且其峰值也会随着TBHQ的加入而变强。并且逐渐出现了新的吸收峰,位于262 nm和282 nm处,再一次证实两者之间存在一定的相互作用,也从侧面证明食品添加剂是可以与DNA发生反应,进而影响人体健康的。
图3 实验1的吸收光谱
图4 实验2的吸收光谱
为了量化分析抗氧化剂TBHQ与ctDNA的反应,需要利用MCR-ALS(Multivariate curve resolutionalternating least squares,多元曲线分辨-交替最小二乘)方法,对上文建立的数据矩阵进行数据处理。
MCR-ALS是一种已经被证实的有效处理复杂数据的建模方法,可用于作为化学计量的分析工具。通过对前文矩阵的奇异值分解,可以获得该矩阵的特征值,分别为114.53、56.71、53.22和3.45。可以证明混合后的溶液体系中存在这一组分。
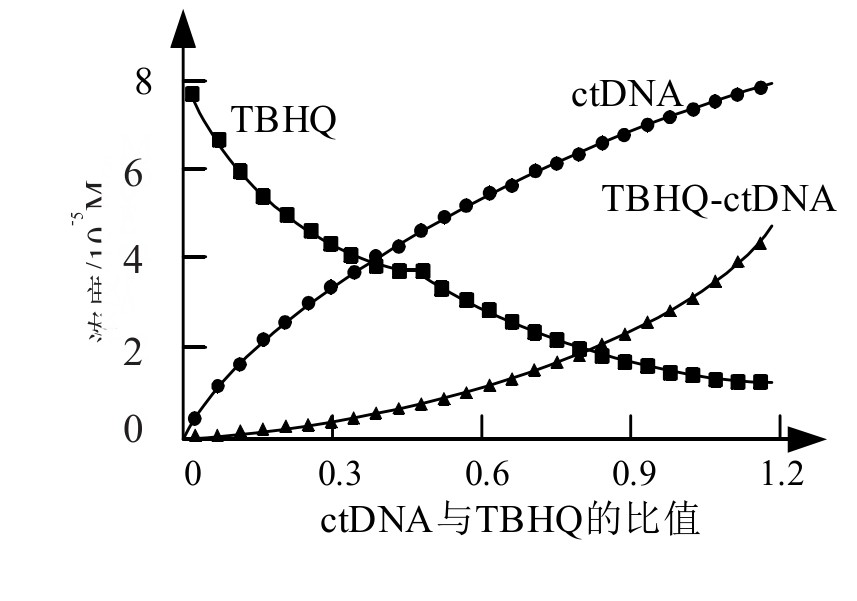
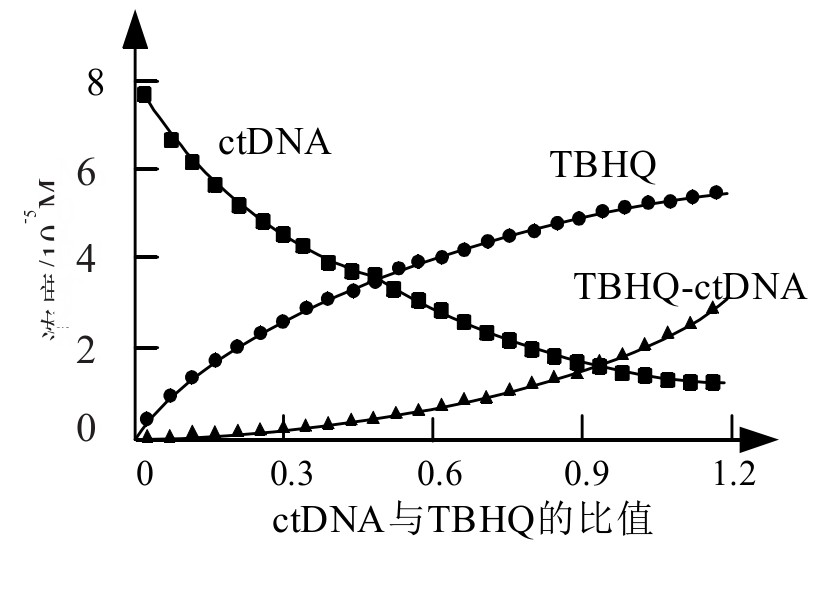
获得组分与光谱曲线的关系曲线如图5、图6所示。图中可以看到,随着后续溶液的持续添加,TBHQ-ctDNA的组分越来越高。而且,没有参与反应的ctDNA和TBHQ光谱与实验数据相符,证明该方法可以有效监测TBHQ-ctDNA复合物的含量,从而优于传统的检测方法。
除了可以获得上述的曲线以外,通过经过修正处理的斯特恩-沃姆方程,可以获得ctDNA与TBHQ之间发生作用的结合常数[15]。该方程表示为式(1)。
式(1)中,k0为其结合系数。通过热力学统计的方法可以获得其结合系数与温度的关系,并将其与产物TBQ进行对比。可知,两者的结合力,明显前者远强于后者,从而可以说明,随着人体代谢的逐渐作用,添加剂TBHQ逐渐分解,使得其毒副作用逐渐减弱。但是量级上,TBHQ及其产物对于DNA的亲和力还是很高,会对DNA产生不可预期的作用,需要在食物中加以控制。
图5 实验1中浓度变化趋势图
图6 实验2中浓度变化趋势图
3 结论
本研究主要研究了基于紫外-可见吸收光谱的方法,测量食品中添加剂的含量问题,并分析TBHQ等食品添加剂与人体DNA的作用机理。结合MCR-ALS方法,实验结果表明,TBHQ等食品添加剂均能够与ctDNA相结合,且具有较大的作用力,而两者的结合可以紫外光谱进行检测。ctDNA的含量逐渐提高,会改变TBHQ位于260 nm和287 nm的紫外吸收光谱,而TBHQ的加入同样会使得ctDNA的紫外吸收光谱出现位于262 nm和282 nm的吸收峰,侧面证明食品添加剂是可以与DNA发生反应,进而影响人体健康。
4 讨论
与普通的研究方法不同,本研究通过对于体外生理条件的模拟,对于TBHQ等食品添加剂与人体ctDNA的结合通过紫外光谱进行检测,可以有效用于研究食品添加剂的作用机理,并可以对食品添加剂的危害加以快速评价。然而由于人体的体内环境更复杂,不同食品添加剂的作用机理并不完全相同,从而需要建立更全面的体内环境,来对生物大分子等相互作用进行研究,对于食品添加剂等进行精确的毒理分析,明确不同食品添加剂的效果和对人体的影响。同样,利用紫外-可见吸收光谱等其他检测手段同样可以用于发掘食品添加剂的营养价值,通过方法的优化,可以对待检测食品做到不漏判、不错检,剔除检测过程中的干扰项,能够快速、高效地对食品添加剂的剂量等进行精确控制和准确引导,保证其更好的服务于人体健康。
 发布时间:2025-11-22
发布时间:2025-11-22